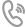華東理工大學開發(fā)高效NADPH再生系統(tǒng)
發(fā)布時間:
2023-07-18
在當前的制藥工業(yè)中,酶催化的氧化還原反應起著至關重要的作用。作為最常用的氫供體,煙酰胺腺嘌呤二核苷酸(NADH)和煙酰胺腺嘌呤二核苷酸磷酸(NADPH)幾乎占據了生物催化氧化還原過程的90%。然而,野生煙酰胺腺嘌呤二核苷酸脫氫酶(FDH)大多數依賴于NAD,相較于其他酶類工具如葡萄糖脫氫酶,其催化活性表現(xiàn)較差。因此,為了實現(xiàn)可靠且穩(wěn)健的NADPH再生系統(tǒng),需要開發(fā)高效且能夠利用NADP的FDH。
T4T7 解碼合成生物 2023-07-18 18:45 發(fā)表于上海

在當前的制藥工業(yè)中,酶催化的氧化還原反應起著至關重要的作用。作為最常用的氫供體,煙酰胺腺嘌呤二核苷酸(NADH)和煙酰胺腺嘌呤二核苷酸磷酸(NADPH)幾乎占據了生物催化氧化還原過程的90%。然而,野生煙酰胺腺嘌呤二核苷酸脫氫酶(FDH)大多數依賴于NAD,相較于其他酶類工具如葡萄糖脫氫酶,其催化活性表現(xiàn)較差。因此,為了實現(xiàn)可靠且穩(wěn)健的NADPH再生系統(tǒng),需要開發(fā)高效且能夠利用NADP的FDH。
近日,華東理工大學許建和團隊在《ChemBioChem》雜志發(fā)表了題為“Engineering a Formate Dehydrogenase for NADPH Regeneration”的研究論文,報道了一個新的來自杜氏假絲酵母的甲酸脫氫酶(CdFDH),通過結構引導的理性設計使得CdFDH未展現(xiàn)出嚴格的NAD偏好性,并具有良好的NADP利用能力,能夠支持不同NADPH依賴的生物催化反應。
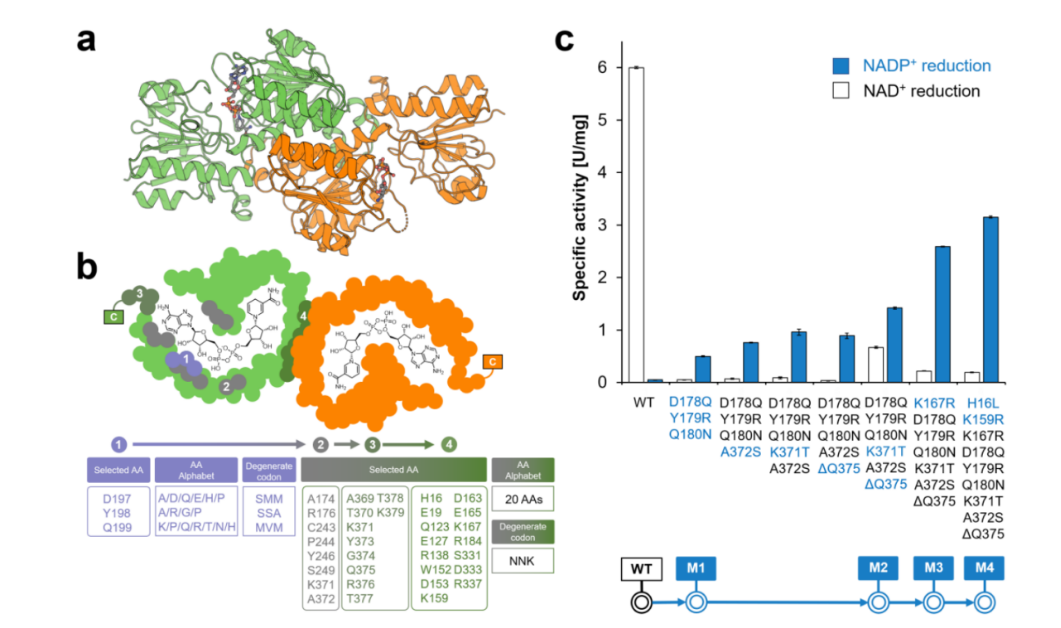
圖1. CdFDH的蛋白結構和突變進化路徑
在之前的研究中,該團隊通過理性設計,成功改造了一個來自伯克霍爾德菌(Burkholderia stabilis)的NADP依賴性突變體(BstFDH-G146M/A287G)。然而,進一步的隨機突變未能獲得更高催化活性的突變體。因此,研究人員轉向了其他FDHs,尋找更好的蛋白質工程起點。而CdFDH作為NADP依賴性FDH的一個全新成員,成為了理想的研究對象。通過結構引導的理性/半理性設計,CdFDH沒有表現(xiàn)出嚴格的NAD依賴性,并且在構建的組合突變體CdFDH-M4(D197Q/Y198R/Q199N/A372S/K371T/?Q375/K167R/H16L/K159R)中,其對NADP的催化效率(kcat/Km)提高了75倍。CdFDH-M4在多種不對稱氧化還原過程中表現(xiàn)出色,其輔酶總周轉數(TTN)范圍從135增至986,使其具備潛力能夠用于需要NADPH的生物催化反應。

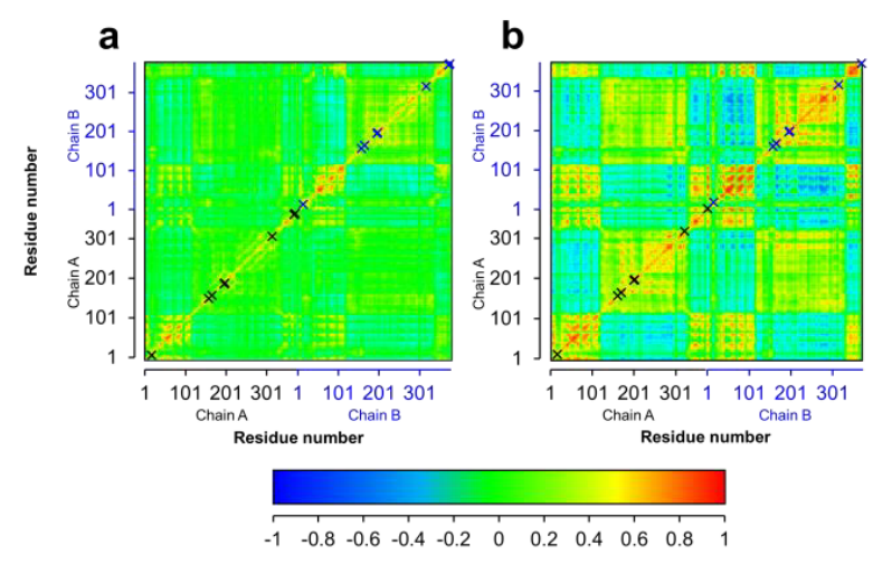
圖2. 野生型和突變體M4輔因子結合環(huán)境比較
之后,該團隊以2.3 Å的分辨率成功得到了最佳突變體CdFDH-M4與NADP的共結晶(PDB:8J3P)。研究發(fā)現(xiàn),與野生型相比,煙酰胺輔酶的結合環(huán)境發(fā)生了巨大的變化,因此導致了更好的NADP適應性。突變位點D197Q、Y198R和Q199N,CdFDH-M4在NAD(H)核糖的羥基附近提供了更大的空間,以容納的磷酸基團,突變位點Gln197、Arg198和Asn199殘基與NAD(P)H的磷酸基團也形成了氫鍵網絡。此外,突變位點A372S則引入了全新的氫鍵網絡(圖2),并且,來自另一個亞基的Lys3與NAD(P)H的磷酸基團支持了額外的極性接觸,而在野生型酶中沒有觀察到這種情況。
總之,這項研究成功改造了一種高效的NADP依賴的FDH突變體(CdFDH-M4),為煙酰胺輔酶的再生提供了有力支持。CdFDH-M4具有良好的NADP利用能力,能夠支持不同類型NADPH依賴的生物催化反應。結構分析和分子動力學研究揭示了突變位點在促進底物/輔酶結合以及FDH催化循環(huán)轉化方面的關鍵作用。同時,研究也為擴展NADPH再生系統(tǒng)提供了有價值的示例,為改進該FDH超家族的輔因子偏好性提供了啟發(fā)。
相關新聞


 ENGLISH
ENGLISH